“Nunca considereis el estudio como una obligación, sino como una oportunidad para penetrar en el bello y maravilloso mundo del saber”.
Albert Einstein
Bienvenidos al nuevo curso escolar. En este blog podras encontrar animaciones, software, prácticas, vídeos, imágenes, fichas de actividades, entre otros recursos, de contenidos concretos que ayuden a mejorar la comprensión y la motivación
hacia estas materias.
hacia estas materias.
http://www.youtube.com/watch?feature=player_embedded&v=5aBHrcv-fh4
http://www.youtube.com/watch?feature=player_embedded&v=0UPRyzlWC6k
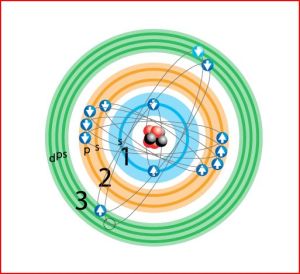
Bohr supuso que los electrones están dispuestos en capas definidas, o niveles cuánticos, a una distancia considerable del núcleo. La disposición de los electrones se denomina configuración electrónica. El número de electrones es igual al número atómico del átomo: el hidrógeno tiene un único electrón orbital, el helio dos y el uranio 92. Las capas electrónicas se superponen de forma regular hasta un máximo de siete, y cada una de ellas puede albergar un determinado número de electrones. La primera capa está completa cuando contiene dos electrones, en la segunda caben un máximo de ocho, y las capas sucesivas pueden contener cantidades cada vez mayores. Ningún átomo existente en la naturaleza tiene la séptima capa llena. Los “últimos” electrones, los más externos o los últimos en añadirse a la estructura del átomo, determinan el comportamiento químico del átomo.
Siempre teniendo en cuenta que el radio atómico esta determinado por cuán fuerte atrae el núcleo a los electrones. A mayor carga nuclear efectiva, los electrones estarán mas fuertemente enlazados al núcleo y menor será el radio atómico
En el Segundo periodo de la tabla periódica los elementos del Li al F, el número de niveles es el mismo 2, es decir todos tienen un orbital 1s lleno y el subnivel 2 pasa de tener 1 electrón en el Litio a tener 7 en el caso del Fluor. Como vimos y es de esperar la carga nuclear efectiva aumenta, por lo tanto hay una mayor atracción del núcleo por los últimos electrones y el radio atómico disminuye constantemente del Litio al Fluor.
A medida que se desciende en un grupo, por ejemplo el grupo IA se encuentra que el radio atómico aumenta según aumenta el número atómico. Esto se explica por que la carga nuclear efectiva permanece prácticamente constante, pero el número de niveles aumenta. Como el tamaño de los orbitales aumenta con el incremento del número cuántico principal, n, el tamaño de los átomos metálicos aumenta del Li al Cs. El mismo razonamiento se puede explicar a los elementos de otros grupos.
Estructura de la tabla periódica
La tabla periódica consta de 7 filas horizontales o periodos, numerados del 1 al 7, y de 18 columnas verticales o grupos, numerados del 1 al 18.
La tabla periódica consta de 7 filas horizontales o periodos, numerados del 1 al 7, y de 18 columnas verticales o grupos, numerados del 1 al 18.
Metales abarcan del grupo I al Grupo 13 donde arranca una diagonal que divide los metales con los no metales . Esta diagonal arranca en el periodo 2 grupo 13 y finaliza en el periodo 7 ,grupo 17.
Y de ultimo tenemos los Gases inertes que son el ultimo grupo de la tabla marcados con color amarillo
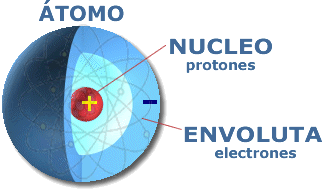
Al referirnos a la configuración electrónica estamos hablando de la descripción de la ubicación de los electrones en los distintos niveles (con subniveles y orbitales) de un determinado átomo.
Científicamente, diremos que es la representación del modelo de la mecánica cuántica. En esta representación se indican los niveles, subniveles y los orbitales que ocupan los electrones.Configurar significa "ordenar" o "acomodar", y electrónico deriva de "electrón"; así, configuración electrónica es la manera ordenada de repartir los electronesen los niveles y subniveles de energía.
Por ejemplo :
Magnesio 12 1s2 2s2 2p6 3s2
Aluminio 13 1s2 2s2 2p6 3s2 3p1
Silicio 14 1s2 2s2 2p6 3s2 3p2
Carbono 6 1s2 2s2 2p2
Nitrógeno 7 1s2 2s2 2p3
REGLA AUFBAU :
El principio de Aufbau contiene una serie de instrucciones relacionadas a la ubicación de electrones en los orbitales de un átomo. También se conoce popularmente con el nombre de regla del serrucho.
Los orbitales se 'llenan' respetando la regla de Hund, que dice que ningún orbital puede tener dos electrones antes que los restantes orbitales de la misma subcapa tengan al menos uno. Se comienza con el orbital de menor energía.
Primero debe llenarse el orbital 1s (hasta un máximo de dos electrones), esto de acuerdo con el número cuántico .
Seguido se llena el orbital 2s (también con dos electrones como máximo).
La subcapa 2p tiene tres orbitales degenerados en energía denominados, según su posición tridimensional, 2px, 2py, 2pz. Así, los tres orbitales 2p puede llenarse hasta con seis electrones, dos en cada uno. De nuevo, de acuerdo con la regla de Hund, deben tener todos por lo menos un electrón antes de que alguno llegue a tener dos.
Y así, sucesivamente:
1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p6
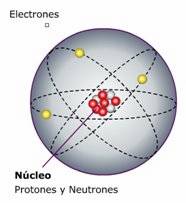 |
| Modelo atómico general.
En las interacciones entre los distintos átomos sólo intervienen los electrones situados en la capa más externa .Los denominados electrones de valencia situados en la llamada capa de valencia, ya que al ser electrones que se encuentran más lejanos del núcleo y más apantallados por los restantes electrones, son los que estan retenidos más debilmente y los que con más facilidad se pierden.Todos los átomos tienden a tener en su capa de valencia únicamente ocho electrones. Así que el número real de electrones de su capa de valencia influirá tambien en sus propiedades.

Vemos que se puede utilizar el orden de energías de los orbitales para describir la estructura electrónica de los átomos de los elementos. Un subnivel s se puede llenar con 1 ó 2 electrones. El subnivel p puede contener de 1 a 6 electrones; el subnivel d de 1 a 10 electrones y el subnivel f de 1 a 14 electrones. Ahora es posible describir la estructura electrónica de los átomos estableciendo el subnivel o distribución orbital de los electrones. Los electrones se colocan primero en los subniveles de menor energía y cuando estos están completamente ocupados, se usa el siguiente subnivel de energía superior :
  |